作者:江训昌 1,2 喻科霖 3杨大祥 1,2,4 廖敏会 5周洋 5
单位:1. 重庆交通大学绿色航空技术研究院;2. 重庆交通大学;3. 重庆市育才中学;4. 绿色航空能源动力重庆市重点实验室;5. 重庆长安新能源汽车有限公司
引用:江训昌, 喻科霖, 杨大祥, 等. 原位聚合制备PDOL基固态电解质及其在锂金属电池中的应用[J]. 储能科学与技术, 2025, 14(1): 1-12.
DOI:10.19799/j.cnki.2095-4239.2024.0712
本文亮点:1、利用同轴静电纺丝技术,制备了在PVDF纤维表面包覆有钇稳定氧化锆(YSZ)无机纳米颗粒的YPVDF纳米纤维,将YPVDF纳米纤维膜替代传统的聚烯烃商用隔膜作为聚合物固态电解质的基膜使用,解决了商用隔膜洗液率低、耐热性差、对有机类电解质前驱体溶液浸润性差的问题。2、采用与锂金属稳定性良好的1,3-二氧戊环(DOL)作为聚合物前驱体单体,结合原位聚合工艺制备出室温下具有良好离子电导率的PDOL基固态电解质。3、YSZ通过同轴静电纺丝的技术包覆在PVDF纤维表面,改善了传统无机填料直接添加到电解质前驱液中易团聚的现象,制备出的复合固态电解质性能更稳定。且YSZ可以协同引发剂促进DOL单体的聚合转化率,减少固态电解质的液体含量,提升电解质的稳定性和安全性。
摘 要 通过同轴静电纺丝工艺,制备出在聚偏氟乙烯(PVDF)纳米纤维表面包覆了氧化钇稳定氧化锆(YSZ)纳米颗粒的YPVDF纳米纤维膜,并以1,3-二氧戊环(DOL)为聚合物前驱体单体,三(三氟磺酸)铝[Al(OfT)3]为引发剂,双三氟甲基磺酰亚胺锂(LiTFSI)为锂盐,氟代碳酸乙烯酯(FEC)为SEI膜添加剂,采用原位聚合工艺,在高比表面积的YPVDF纳米纤维基膜中原位聚合生成PDOL基复合固态电解质,PDOL与YPVDF纤维表面的YSZ形成大量的YSZ/PDOL有机-无机离子快速传输界面,制备出的PDOL@YPVDF-CSE在室温下拥有0.94×10-4 S/cm的离子电导率;YPVDF纤维上YSZ的Lewis酸位点(Zr4+、Y3+、氧空位)能够吸附LiTFSI中的阴离子,促进LiTFSI解离出Li+,从而使得PDOL@YPVDF-CSE具有0.78的锂离子迁移数,同时YSZ提供的Lewis酸位点可以协同Al(OfT)3促进DOL开环聚合,使DOL单体的转化率达到98.2%。此外,YPVDF纳米纤维的引入使得PDOL@YPVDF-CSE的耐热分解温度提升至312 ℃。以PDOL@YPVDF-CSE组装的Li|PDOL@YPVDF-CSE|Li锂对称电池,能够稳定循环1500 h以上;组装的LFP|PDOL@YPVDF-CSE|Li电池在0.5C倍率下循环800次以后,容量保持率为97.4%,在2 C倍率下循环500次后,容量保持率为96.8%。同时,以LiNi0.6Co0.2Mn0.2O2(NCM622)为正极组装的NCM622|PDOL @YPVDF-CSE|Li电池在1 C倍率下循环150次后,容量保持率为96.2%。
关键词 同轴静电纺丝;聚(1,3-二氧戊环);原位聚合;电化学性能;复合固态电解质
锂离子电池(LIBs)的应用需求正经历着前所未有的增长,其应用领域日渐扩大,从日常的便携式电子设备延伸至大型储能系统领域,展现了其作为能源存储解决方案的惊人潜力。然而,当前传统LIBs在日益增长的需求中也面临诸多挑战,主要包括能量密度的瓶颈(约300 Wh/kg)以及采用可燃液态电解液所引发的安全隐患。为有效克服这些技术难题,固态电池(SSB)作为创新解决方案应运而生,SSB采用的是固态电解质(SSE),从而使得其能够搭配锂(Li)金属负极。这一设计不仅有望突破能量密度的现有上限,还极大地降低了因液态电解质的可燃性而带来的安全风险,为锂离子电池技术的未来发展开辟了新途径。一直以来,SSE与电极之间的界面问题是阻碍SSB商业化进程的关键难题之一。SSE与电极之间接触不良,导致存在较大的界面阻抗,进而阻碍了锂离子的有效传输,严重削弱了电池的整体性能。为了应对这一难题,研究人员积极探索并采用了多种创新策略,旨在构建出既具备低电阻又保持优异化学/电化学稳定性的界面。这些策略包括但不限于:通过调整堆叠压力来优化电解质(如硫化物、聚合物)与电极材料(特别是锂金属阳极)的接触形态;采用低温烧结技术改善无机阴极材料与电解质的结合;设计并构建人工界面层以增强电解质与电极的兼容性;利用熔体渗透技术使电解质深入电极内部;开发湿涂层技术,在电极表面均匀涂布液态前驱体,随后通过特定处理转化为固态界面层;实施原位聚合方案,基于液态电解质在电极表面直接形成固态界面层;等等。这些方法的综合应用为固态电池界面问题的解决提供了多元化的技术路径。
近年来,原位聚合作为一种制备SSE的极具潜力的方法,在加工和成本方面均展现出显著优势。尽管该方法目前仍面临聚合不均匀和聚合速率难以预测等问题,但由于其能在特定条件下将液体单体转化为固体聚合物的独特优势,有效地解决了固态电解质与固态电极之间界面接触不良的问题。其中,聚(1,3-二氧戊环)(PDOL)作为1,3-二氧戊环(DOL)的聚合产物,在锂离子电池应用中展现出巨大潜力。这主要得益于DOL对Li负极出色的稳定性、PDOL室温下较高的离子电导率以及简便的聚合工艺等优点。聚合物固态电解质(SPE)因具有优异的加工性和灵活性受到广泛关注,然而,其固有的低离子电导率(尤其是在低温环境下),限制了其广泛应用。Ren等以氟代碳酸乙烯酯(FEC)为增塑剂,采用DOL原位开环聚合法,制备了具有高低温离子传导能力的准聚合物固态电解质(QSPE)。原位聚合使QSPE与电极有良好的界面接触,FEC提高PDOL分子链流动性并促进LiTFSI的解离,从而使得QSPE在-60 ℃的低温时仍拥有2.4×10-5 S/cm的离子电导率以及-20 ℃时0.55的Li+迁移数。同时,利用QSPE组装的Li|QSPE|Li电池,可在0.2 mA/cm2(0 ℃)的电流密度下循环850 h后仍保持较低的极化电压。Zhu等通过阳离子开环聚合,并使用四臂交联剂进行原位交联的方法制备了一种凝胶聚合物电解质(c-GPE),密集的3D交联聚合物网络使c-GPE具有高溶剂吸收能力和优异的氧化稳定性。此外,交联聚合物网络与溶剂之间的强相互作用,降低了Li+的脱溶能垒,能促进Li+的均匀沉积。利用这种原位聚合制备的c-GPE组装的Li|c-GPE|LFP电池拥有出色的循环寿命,在2000次循环后具有78%的容量保持率。这种原位3D交联凝胶聚合物电解质与高压阴极材料LiNi0.6Mn0.2Co0.2O2(NCM622)也具有良好的适配性,Li|c-GPE|(NCM)电池经过300次循环后容量保持率为80%。Geng等使用LiPF6作为DOL开环聚合的引发剂,LiPF6起到促进DOL室温下开环聚合和防止铝集流体腐蚀的双重作用。在电化学过程中,由于FEC和六亚甲基二异氰酸酯(HDI)的协同作用,在质子的辅助下形成了稳定性良好的界面层,提高了电解质与LiCoO阴极之间的界面稳定性,并通过DFT计算,分析了FEC与HDI之间的反应机理。室温下组装的LiCoO/Li电池表现出良好的电化学性能。这为采用原位聚合和电化学界面工程的方法设计高压固态锂金属电池提供了新途径。Yang等报道了一种高度均质的PDOL复合固体电解质(CSE)膜,通过氧化钇稳定氧化锆(YSZ)纳米颗粒对DOL原位催化聚合效应,YSZ纳米颗粒催化剂促使DOL单体聚合转化高达98.5%,其电化学窗口超过4.9 V。YSZ还显著提高了室温离子电导率(2.75×10-4 S/cm),提高了金属锂阳极的循环寿命。基于此PDOL基CSE组装的NCM622/Li固态锂电池拥有超过800次的长循环寿命。原位聚合PDOL基固态电解质虽然拥有诸多优秀表现,但在以往研究中,DOL原位聚合时仍使用传统商业隔膜作为基体,传统聚烯烃隔膜存在孔隙率较低、吸液效果不佳、热稳定性较差等性能缺陷。此外,有机类电解液对聚烯烃隔膜亲和力不足,固态电解质前驱体溶液浸润速度较慢,这会导致在大容量电芯生产过程中聚合物单体在电解液充分浸润隔膜前就发生聚合反应,从而导致电解质基质在隔膜内分布不均,甚至是难以渗透隔膜浸润到电池正负极,从而影响电池性能。
为此,针对以上问题,本文在选用DOL作为聚合物单体的基础上,采用同轴静电纺丝技术,制备了在PVDF纳米纤维表面包覆氧化钇稳定氧化锆(YSZ)纳米颗粒的YPVDF纳米纤维膜,并以YPVDF纳米纤维膜来代替商业聚烯烃隔膜作为原位聚合的基体。高孔隙率的YPVDF纳米纤维膜能够为PDOL电解质基质提供充足的容纳空间,扩大了电解质膜中的Li+有效传输区域。YSZ无机纳米颗粒通过同轴静电纺丝的方式包覆到每根PVDF纤维上,YSZ颗粒仅分布在纤维表面,使YSZ能和PDOL充分接触,提高了YSZ的有效利用率,同时,可以保持纤维内部的连续性和完整性,从而保证YPVDF纤维膜的力学性能。此外,相比于将无机填料直接添加到电解质前驱体溶液中的传统方法,此方式可以在一定程度上改善YSZ在电解质中发生团聚的现象。通过引发剂三(三氟磺酸)铝[Al(OfT)3]在室温下引发DOL单体发生初步开环聚合,YSZ提供的Lewis酸位点不仅能进一步协同促进DOL聚合,使DOL的单体转化率提升,降低电解质内DOL单体残余比例,从而提升电解质的稳定性和安全性能,还能吸附锂盐LiTFSI的阴离子,促进其解离,提升电解质中的载流子浓度。此外,YSZ与PDOL形成的有机-无机界面构筑了离子快速传输路径,能够进一步提升电解质的离子传输效率。
1 实验材料和方法
1.1 材料
1,3-二氧戊环(DOL),分析纯,上海麦克林生化科技股份有限公司;三(三氟磺酸)铝[Al(OfT)3],99.9%,上海麦克林生化科技股份有限公司;镍钴锰三元锂(NCM622),LiNi0.6Co0.2Mn0.2O2,阿拉丁试剂(上海)有限公司;氟代碳酸乙烯酯(FEC),分析纯,上海麦克林生化科技股份有限公司;N,N-二甲基甲酰胺(DMF),分析纯,上海麦克林生化科技股份有限公司;磷酸铁锂(LFP),LiFePO4 ,湖南长远锂科股份有限公司;锂片,直径16 mm,天津中能锂业有限公司;氧化钇稳定氧化锆(YSZ),8Y,中冶新材料;聚偏氟乙烯(PVDF),Mw=110 万,法国阿科玛;导电炭黑(Super-P),瑞士 lmerys;N,N-二甲基吡咯烷酮(NMP),分析纯,上海麦克林生化科技股份有限公司。
1.2 测试设备
场发射扫描电子显微镜(scanning electron microscope,SEM),GeminiSEM 360型;X射线衍射仪(X-ray diffraction,XRD),日本理学Rigaku Ultima IV;热重分析仪(thermal gravimetric analyzer,TGA),Mettler Toledo TGA2;差示扫描量热仪 (differential scanning calorimeter,DSC),TA DSC25;电化学工作站,CHI660E型,上海辰华仪器有限公司;蓝电电池充放电测试设备,CT3001A,武汉市蓝电电子股份;核磁共振仪,德国Bruker 400M;X射线光电子能谱(X-ray photoelectron spectroscopy,XPS),Thermo Scientific K-Alpha;傅里叶红外光谱仪(Fourier transform infrared spectrometer,FTIR spectrometer),NICOLET iS50 FT-IR。
1.3 PDOl基固态电解质前驱体溶液的制备
将DOL、FEC按体积比10∶1混合并搅拌均匀,再将锂盐LiTFSI(2 mol/L)溶解到混合溶液中,用磁力搅拌器在室温下搅拌2 h,再加入0.01 mol/L的Al(OfT)3作为引发剂,室温下搅拌30 min,得到澄清透明的电解质前驱体溶液。
1.4 固态电池的制备流程及电化学测试
(1)同轴静电纺丝制备YPVDF纳米纤维膜
配置质量分数为12%的PVDF/DMF溶液,向其中添加YSZ粉末,添加量为PVDF质量的0.6%,并在室温下搅拌12 h,使YSZ粉末颗粒均匀分散到溶液中,得到混合均匀的YSZ/PVDF/DMF溶液。PVDF/DMF溶液作为同轴纤维的内芯层纺丝液,YSZ/PVDF/DMF溶液作为同轴纤维的外壳层纺丝液,使用17/22不锈钢同轴针头进行纺丝。总供料速度为1.5 mL/h,纺丝电压为19 kV,接收距离为15 cm,接收滚筒的转速为300 r/min。纺丝过程中的环境温度和湿度分别控制为30 ℃和30%,持续纺丝3 h后,将纤维膜于80 ℃真空烘箱中干燥12 h,以去除纤维膜上残留的溶剂,得到厚度约为50 μm的纳米纤维膜,将所得的纳米纤维膜命名为YPVDF。将YPVDF纳米纤维膜使用冲片机进行冲片,得到直径18 mm的小圆片并转移至手套箱待用。
(2)正极极片的制备
按质量比8∶1的比例称取LFP和Super-P,将其混合并在研钵中充分研磨30 min,将研磨后的混合粉末在真空烘箱中110 ℃干燥12 h。将和Super-P等质量的PVDF粉末溶解到适量的NMP溶剂中,配制质量分数为3.4%的PVDF/NMP溶液,将干燥后的LFP和Super-P粉末及PVDF/NMP溶液用真空行星搅拌机搅拌3 h,得到混合均匀的正极浆料。将正极浆料使用极片涂布机涂布在铝箔上,涂布后的极片先置于80 ℃鼓风干燥箱中干燥1 h,然后转移到真空干燥箱中110 ℃下干燥12 h。将干燥后的极片用辊压机进行辊压,然后用冲片机冲成直径16 mm的小圆片并转移至手套箱中待用。所制备的极片的活性物质载量控制在2 mg/cm2左右。
NCM622正极极片的制备流程与LFP正极极片制备流程一致。
(3)固态电池的组装与测试
使用CR2025型纽扣电池壳组装电池,按照LFP或NCM622正极、YPVDF纳米纤维膜、电解质前驱体溶液、锂金属负极的顺序进行组装,每片纤维膜滴加50 μL电解质前驱体溶液,组装后的电池用纽扣电池封口机进行封口,封口压力为50 kg/cm2。封装好的电池在室温下静置24 h,待前驱体溶液充分聚合,此复合固态电解质记为PDOL@YPVDF-CSE。并同样以PVDF纳米纤维膜作为基膜,使用同样的顺序和方法,组装电池作为对照组,对照组的聚合物固态电解质记为PDOL@PVDF-SPE。
组装不同的电池以测试电解质的不同电化学性能:组装不锈钢||不锈钢电池测试电解质的离子电导率;组装Li||Li对称电池测试电解质的锂离子迁移数(t )、过电位循环寿命和临界电流密度(CCD);组装Li||不锈钢电池测试电池的电压窗口。EIS 测试电压振幅为15 mV,频率范围为10-2~106 Hz。LSV测试电压范围为1.0~6.0 V,扫描速率为0.01 mV/s。I-t测试扫描电压为0.01 V,扫描时间为10000 s。
)、过电位循环寿命和临界电流密度(CCD);组装Li||不锈钢电池测试电池的电压窗口。EIS 测试电压振幅为15 mV,频率范围为10-2~106 Hz。LSV测试电压范围为1.0~6.0 V,扫描速率为0.01 mV/s。I-t测试扫描电压为0.01 V,扫描时间为10000 s。
2 实验结果与讨论
2.1 结构与形貌表征分析
2.1.1 SEM分析
如图所示,图1(a)和(b)分别为同轴静电纺丝技术制备的YPVDF纳米纤维和PVDF纳米纤维的SEM图像,对比之下,可以看到PVDF纳米纤维表面光滑均匀,而在YPVDF纳米纤维表面明显观察到有颗粒物分布,结合图1(c)的YPVDF纳米纤维的EDS能谱可以确定,附着在纤维表面的为YSZ纳米颗粒,说明通过同轴静电纺丝技术成功制备出纤维表面包覆YSZ颗粒的YPVDF纳米纤维,YPVDF纤维表面分布的YSZ与PDOL之间的接触面形成大量的YSZ/PDOL界面,能够构筑大量新的有机-无机Li+传输途径。图1(d)为通过原位聚合方法在锂金属表面制备的PDOL@YPVDF-CSE,在截面图像中,锂金属截面有裂纹出现,这是在SEM测试制样过程中,样品截面通过液氮脆化后掰裂断开形成的,脆断过程中在外力的作用下,导致锂金属截面部分区域上出现裂纹或空洞。原位聚合方法制备的PDOL@YPVDF-CSE与锂金属之间结合得非常紧密,两者之间无明显间隙,这使得电解质和电极之间的有效接触面积增加,有利于提升Li+在界面处的传输效率,降低锂金属负极和电解质之间的界面阻抗。此外,图1(e)中PDOL@YPVDF-CSE截面的Zr元素的EDS分析显示,Zr元素在电解质中分布均匀,由于Zr均来源于YSZ纳米颗粒,因此可知,YSZ颗粒在纳米纤维内均匀分布,未出现明显团聚现象。

2.1.2 XRD与DSC测试分析
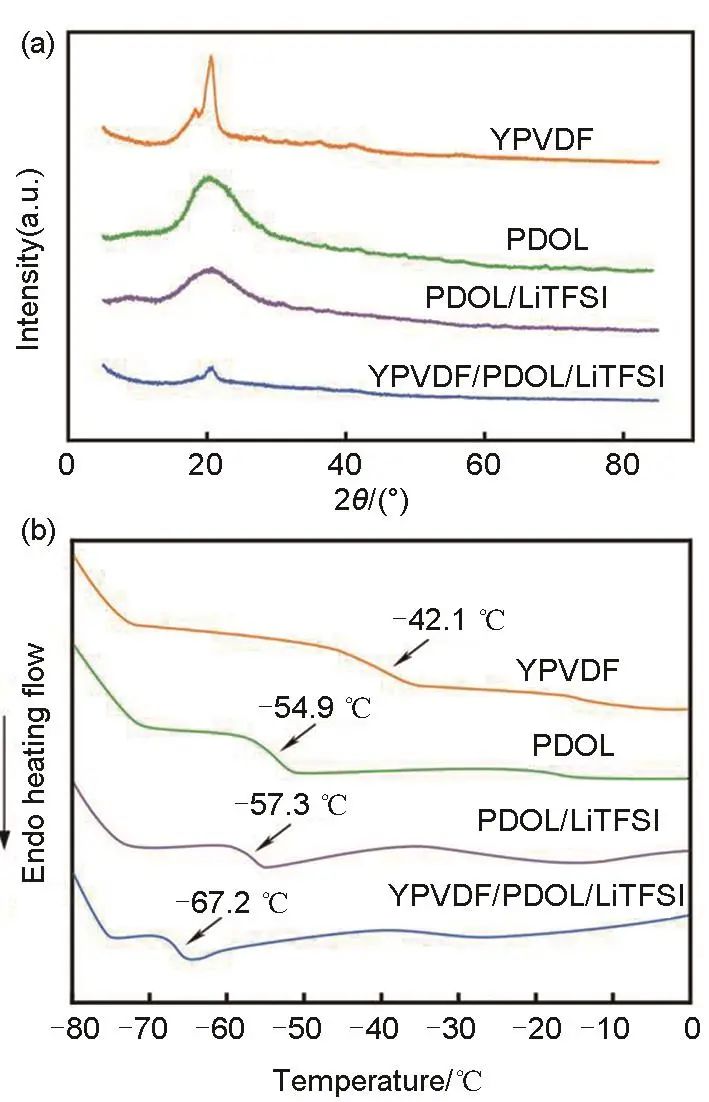
为了评估电解质中各组分的加入对其结晶度和玻璃化转变温度(Tg)的影响,分别对YPVDF纳米纤维膜、PDOL、PDOL/LiTFSI、YPVDF/PDOL/LiTFSI等样品进行了XRD和DSC测试,测试结果如图2(a)和(b)所示,YPVDF纤维膜在18.6°和20.6°处分别出现PVDF中典型的α和β晶相的特征峰。YPVDF纤维膜Tg为-42.1 ℃,YSZ的引入,使其相较于PVDF纤维膜的Tg(-39.5 ℃)有所降低。PDOL单组分聚合物具有较高的结晶度,在10°~30°之间出现衍射峰,其Tg为-54.9 ℃,在PDOL中加入LiTFSI后,其结晶度降低,同时Tg有所下降(-57.3 ℃)。当PDOL与LiTFSI、YPVDF纤维膜同时复合时,其结晶度进一步显著降低,并且Tg降低至-67.2 ℃。非晶区域的增加和玻璃化温度的降低,有利于PDOL聚合物链段的运动性提升,从而增强Li+在电解质中的传输效率。
2.1.3 TG测试分析
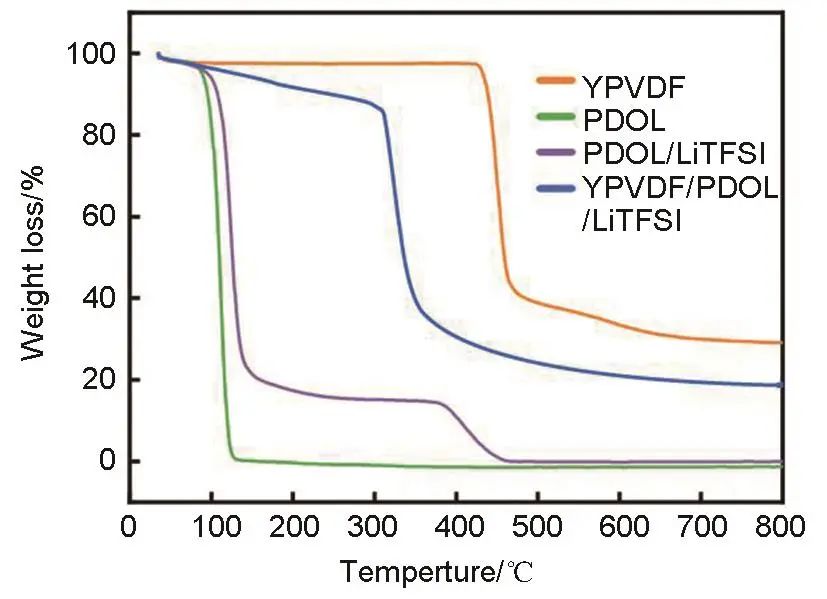
对电解质相关样品组的热稳定性测试结果如图3所示,YPVDF纳米纤维膜在424 ℃之前无明显失重现象,424 ℃之后才开始出现较为明显的失重变化,到625 ℃时才接近完全热分解,拥有优异的热稳定性。PDOL单组分聚合物热稳定性较差,在80 ℃时便开始发生较为严重的热分解。PDOL/LiTFSI复合物的热稳定性同样表现不佳,在90 ℃时开始发生较为明显的失重变化,460 ℃时完全分解。当PDOL和LiTFSI、YPVDF纤维膜同时复合在一起时,312 ℃之前其分解速度失重较为缓慢,复合物在312 ℃之前发生了约13%的失重变化,312 ℃之后开始发生剧烈分解,到480 ℃时近乎完全分解。测试结果表明,相较PDOL单组分和PDOL/LiTFSI复合物,YPVDF纳米纤维的引入可以有效提升PDOL基固态电解质的热稳定性,对于电池的热安全性的提升有积极影响。
2.1.4 FTIR测试分析
YPVDF纳米纤维膜、DOL、PDOL、PDOL/LiTFSI、YPVDF/PDOL/LiTFSI等的FTIR测试曲线如图4所示。YPVDF纳米纤维和YPVDF/PDOL/LiTFSI复合物的红外图谱中可以看到C—F键在1171 cm-1处的特征峰,在DOL、PDOL、PDOL/LiTFSI、YPVDF/PDOL/LiTFSI等样品组中均在3000~2800 cm-1观察到特征峰,此处的特征峰由饱和C—H的拉伸振动引起。在DOL红外图谱中可以在914 cm-1处观察到特征峰出现,此为环醚的特征峰,与此同时,PDOL、PDOL/LiTFSI、YPVDF/PDOL/LiTFSI等样品组中在914 cm-1处的环醚特征峰消失,且在844 cm-1处出现长链特征峰,由此结果可表明,DOL单体在引发剂的作用下聚合成PDOL大分子长链。

2.1.5 氢核磁共振测试分析
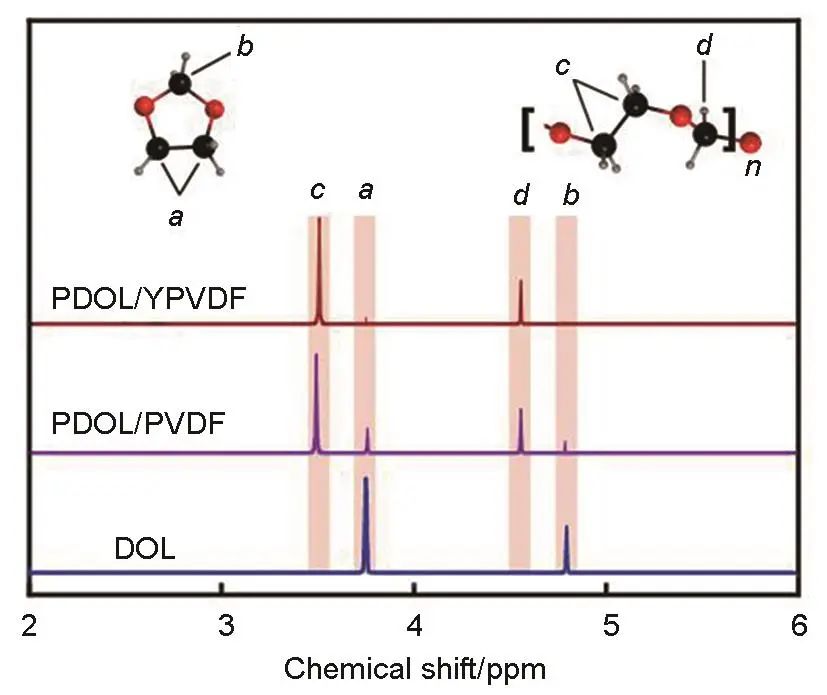
图5为PDOL/PVDF纤维复合物、PDOL/YPVDF纤维复合物以及DOL单体的1H NMR谱。如图所示,3.75 ppm(1 ppm=10-4%)和4.72 ppm处的峰分别为DOL单体分子位置a和b处的H原子的化学环境所产生的,3.8 ppm和4.8 ppm处的峰是由DOL单体聚合成链段后c和d位置的H原子的化学环境所产生的,因此通过比较c/a或d/b的值可以推算出电解质中发生聚合的DOL与未发生聚合的DOL的比值。PDOL/PVDF纤维复合物中的DOL单体发生聚合后,a、b处环境的H原子对应的峰的面积减小,c、d处环境的H原子对应的峰出现,但是在PDOL/PVDF纤维复合物的图谱中a、b处H原子的峰依旧存在,说明此时DOL单体仍残余一部分未发生聚合。在PDOL/YPVDF纤维复合物的图谱中可以看到,a、b处的峰极为微弱,而c、d处H原子对应的峰变强,经计算得到PDOL复合PVDF纳米纤维时DOL单体的转化率为87%,而在PDOL复合YPVDF纳米纤维时DOL单体的转化率提升到98.2%,两组样品对比结果说明YPVDF纤维表面的YSZ的Zr4+、Y3+、氧空位等Lewis酸位点起到促进DOL聚合的效果,提升了DOL的单体转化率。DOL单体转化率的提升,使得电解质中残留的DOL小分子数量减少,大分子链结构的PDOL的比例增加,使得电解质的稳定性和安全性提高。
2.2 电化学性能测试与分析
2.2.1 离子电导率与电化学窗口
离子电导率是电解质最重要和最基础的性能参数之一,离子电导率对电池最终性能的影响至关重要。对于聚合物类电解质而言,在一定温度区间内,温度越高,聚合物的分子链的运动能力越强,电解质的离子电导率表现得越高。如图6(a)所示,其分别为PDOL@YPVDF-CSE和PDOL@PVDF-SPE在30~80 ℃温度区间内的离子电导率,横坐标中T为热力学温度,纵坐标中σ为离子电导率,从图中曲线可以看出,电解质的离子电导率与温度变化呈现正相关,这种变化趋势符合聚合物中的离子传导机理。当温度为30 ℃时PDOL@Y-PVDF电解质的离子电导率为0.97×10-4 S/cm2,温度增加到80 ℃时的离子电导率达到1.2×10-3 S/cm2。PDOL@YPVDF-CSE中的YSZ和PDOL形成大量的YSZ/PDOL无机-有机结合界面,构筑了离子快速传输路径。此外,YSZ的Zr4+、Y3+、氧空位等Lewis酸位点对LiTFSI的阴离子具有吸附作用,促进了锂盐解离,增加了电解质中可自由移动的锂离子的数量和比例。在多种因素的协同作用下,锂离子的传输效率有所提升,从而使PDOL@YPVDF-CSE具有更高的离子电导率。
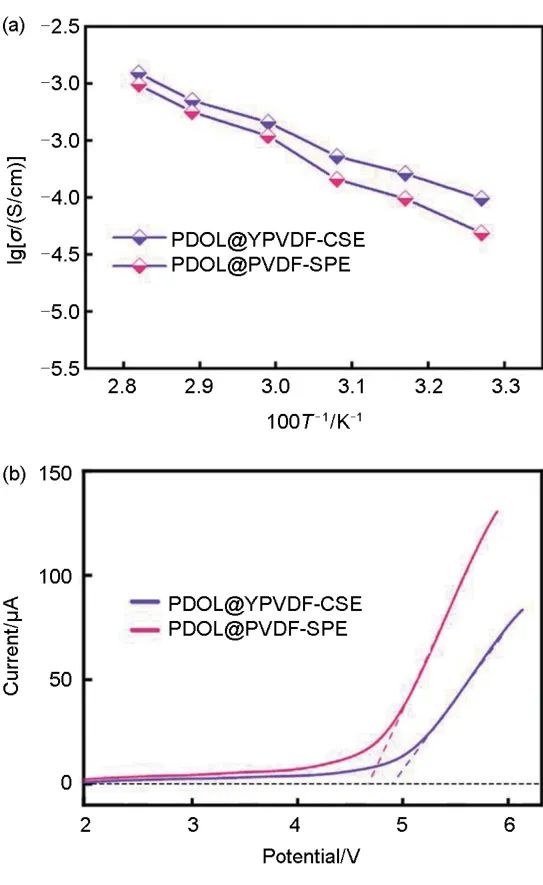
图6 (a) PDOL@YPVDF-CSE、PDOL@YPVDF-SPE在不同温度下的离子电导率;(b) PDOL@YPVDF-CSE、PDOL@YPVDF-SPE的电化学窗口
图6(b)为PDOL@PVDF-SPE和PDOL@ YPVDF-CSE的电化学窗口曲线,PDOL@PVDF-SPE在4.7 V时开始发生氧化分解,而PDOL@YPVDF-CSE能够承受4.9 V的电压,这是由于PDOL@YPVDF-CSE中的YSZ提升了DOL单体的转化率,使电解质中的DOL小分子单体含量显著降低,提升了大分子链结构的PDOL的比例,从而使得电解质表现出更好的电化学稳定性。
2.2.2 锂离子迁移数
图7(a)和(b)分别为Li|PDOL@YPVDF-CSE|Li和Li|PDOL@PVDF-SPE|Li电池极化前后的EIS阻抗图谱与极化曲线图,通过其在室温下的阻抗图谱可知,两者阻抗值分别约为52 Ω和58 Ω,其较小的阻抗值表明电解质与锂金属电极之间有着相对较好的稳定性,此外结合极化曲线测得电解质的t ,PDOL@PVDF-SPE和PDOL@Y-PVDF的t
,PDOL@PVDF-SPE和PDOL@Y-PVDF的t 分别为0.74和0.78,PDOL@YPVDF-CSE之所以表现出更高的t
分别为0.74和0.78,PDOL@YPVDF-CSE之所以表现出更高的t ,是因为YSZ表面的Zr4+、Y3+、氧空位等Lewis酸位点可以吸附锂盐中的阴离子,促进锂盐解离,增加电解质内游离Li+数量和比例,从而使得PDOL@YPVDF-CSE具有更高的锂离子迁移数。
,是因为YSZ表面的Zr4+、Y3+、氧空位等Lewis酸位点可以吸附锂盐中的阴离子,促进锂盐解离,增加电解质内游离Li+数量和比例,从而使得PDOL@YPVDF-CSE具有更高的锂离子迁移数。
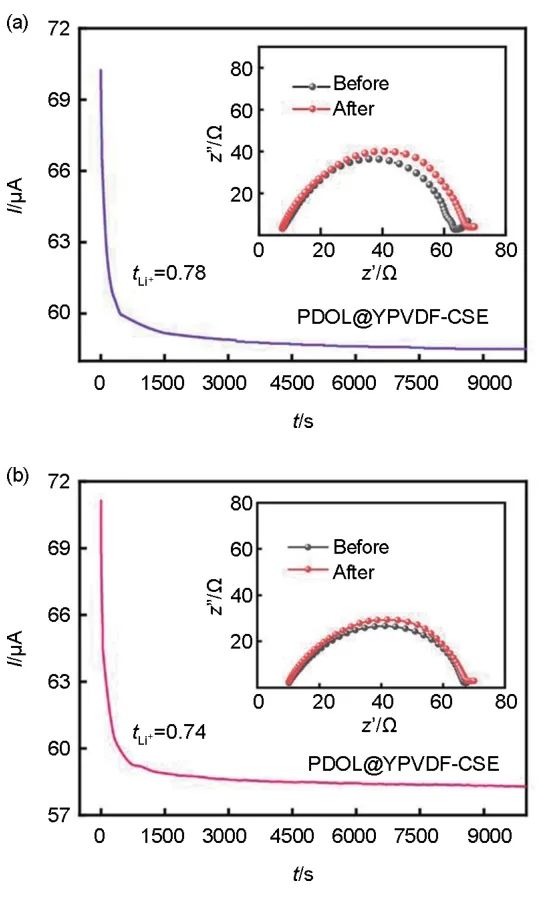
图7 I-t极化曲线和极化前后的EIS阻抗谱:(a) PDOL@YPVDF-CSE;(b) PDOL@PVDF-SPE
2.2.3 界面稳定性测试
图8(a)为Li|PDOL@YPVDF-CSE|Li电池中的电解质固化后,在不同时间测得的界面EIS阻抗谱,电池的初始阻抗仅有51.7 Ω,表明PDOL @YPVDF-CSE中的各组分与锂金属具有相对较好的稳定性,静置一段时间后,其阻抗值略有上升,原因可能是极少部分未聚合的DOL或者是电解质中其他组分与锂金属发生反应,在界面处生成副产物,导致阻抗有所增加,但在第20天后,其界面阻抗值就趋于稳定,原因可能是SEI在锂金属表面形成,阻止了电解质与锂金属进一步反应。
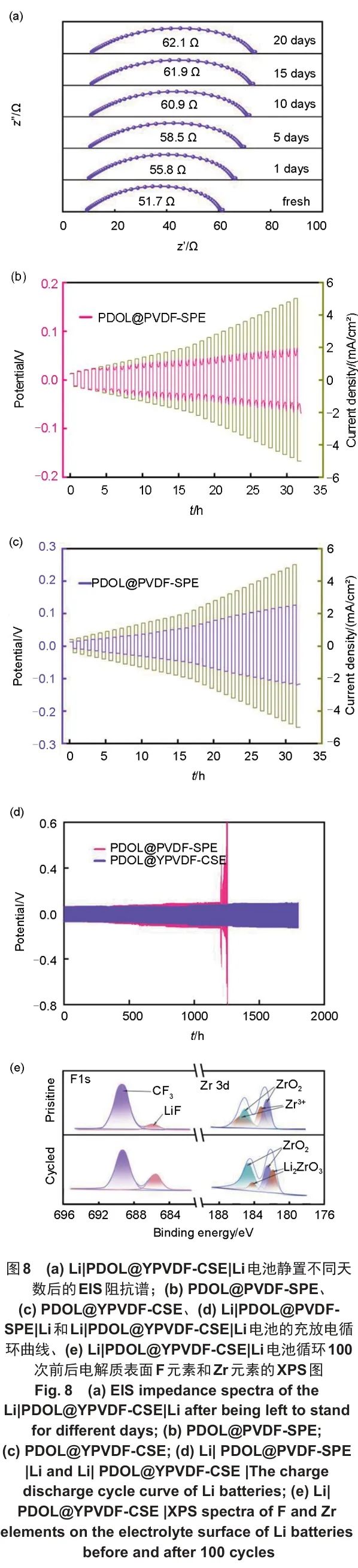
图8 (a) Li|PDOL@YPVDF-CSE|Li电池静置不同天数后的EIS阻抗谱;(b) PDOL@PVDF-SPE、(c) PDOL@YPVDF-CSE、(d) Li|PDOL@PVDF-SPE|Li和Li|PDOL@YPVDF-CSE|Li电池的充放电循环曲线、(e) Li|PDOL@YPVDF-CSE|Li电池循环100次前后电解质表面F元素和Zr元素的XPS图
对Li|PDOL@PVDF-SPE|Li和Li|PDOL@YPVDF-CSE|Li锂对称电池使用0.05~5 mA/cm2范围的电流进行循环,结果如图8(b)和(c)所示,Li|PDOL@YPVDF-CSE|Li在5 mA/cm2的电流密度范围内保持可逆锂沉积/剥离的优异性能,在同电流阶段时其电压曲线始终平稳,而Li|PDOL@PVDF-SPE|Li电池在电流密度增加到1 mA/cm2时,其极化电压曲线就开始出现紊乱。同时,为了验证在充放电长循环过程中锂金属电极上锂的沉积和剥离的稳定性,将Li|PDOL@PVDF-SPE|Li和Li|PDOL@YPVDF-CSE|Li锂对称电池在0.5 mA/cm2的电流密度下,充电或放电时间为0.5 h进行循环。其结果如图8(d)所示,Li|PDOL@YPVDF-CSE|Li电池能够持续稳定循环1800 h,而Li|PDOL@PVDF-SPE|Li在1200 h后极化电压显著增加,说明在锂金属电极表面有大量锂枝晶生成,电解质与锂金属界面处发生恶化,锂金属表面有锂枝晶甚至是死锂形成。Li|PDOL@YPVDF-CSE|Li电池之所以有优秀的可逆锂沉积和剥离性能,是因为PDOL@YPVDF-CSE具有更好的锂离子迁移数,减少了浓差极化现象,锂离子能够在锂金属电极表面更均匀地沉积,减少锂枝晶的出现,同时PDOL@YPVDF-CSE中的未参与聚合的DOL单体数量更少,减少了电解质和锂金属接触界面之间的副反应,使界面更稳定,从而Li|PDOL@YPVDF-CSE|Li电池能够进行更长时间的循环,并且能承受更高的电流密度。
为了进一步探究PDOL@YPVDF-CSE与锂金属之间形成的SEI的组成成分,对Li|PDOL@YPVDF-CSE|Li电池循环100次前后的PDOL@YPVDF-CSE表面进行XPS测试,其中F和Zr元素谱如图8(e)所示,在688.9 eV和685.4 eV处的F1s峰分别对应为C—F和LiF,对比循环前后的LiF峰面积可知,循环后的SEI膜中LiF的含量有明显提升,LiF可以增加SEI的致密性和稳定性,提升Li+在SEI中的传输效率。循环后的Zr3d在181.9 eV和184.3 eV处出现的新的峰均为Li2ZrO3,Li2ZrO3不仅拥有较好的Li+电导率,能够引导Li+均匀沉积,同时还有较高的机械强度,这些特性均有利于抑制锂枝晶生长,延长电池循环寿命。
2.2.4 LFP||Li电池倍率及其循环性能测试
上述的研究和测试表明PDOL@YPVDF-CSE的电化学性能具有良好的表现,为了进一步验证其在电池中的循环性能和倍率性能,以LFP为正极材料,使用PDOL@YPVDF-CSE组装成LFP|PDOL@YPVDF-CSE|Li电池进行充放电测试,并以PDOL@PVDF-SPE组装成LFP|PDOL@PVDF-SPE|Li电池作为对比。电池依次在0.2 C、0.5 C、1 C、2 C、0.2 C的不同倍率大小的电流下各循环5次,以评估电池的倍率性能,其结果如图9(a)所示,LFP|PDOL@PVDF-SPE|Li电池在0.2 C倍率时的初始放电比容量为158.1 mAh/g,电流倍率达到2 C时,放电比容量衰减至115.3 mAh/g,LFP|PDOL@YPVDF-CSE|Li电池在0.2 C放电比容量达到159.6 mAh/g,且在不同倍率的电流下的放电比容量均高于LFP|PDOL@PVDF-SPE|Li电池,当达到2 C的高倍率时,其放电比容量仍有127.8 mAh/g。当电流大小重新回归到0.2 C时,LFP|PDOL@PVDF-SPE|Li电池的放电比容量为151.2 mAh/g,是初始0.2 C倍率时的95.6%,而LFP|PDOL@ YPVDF-CSE|Li电池的放电比容量为154.9 mAh/g,是初始0.2 C倍率时的97.1%。
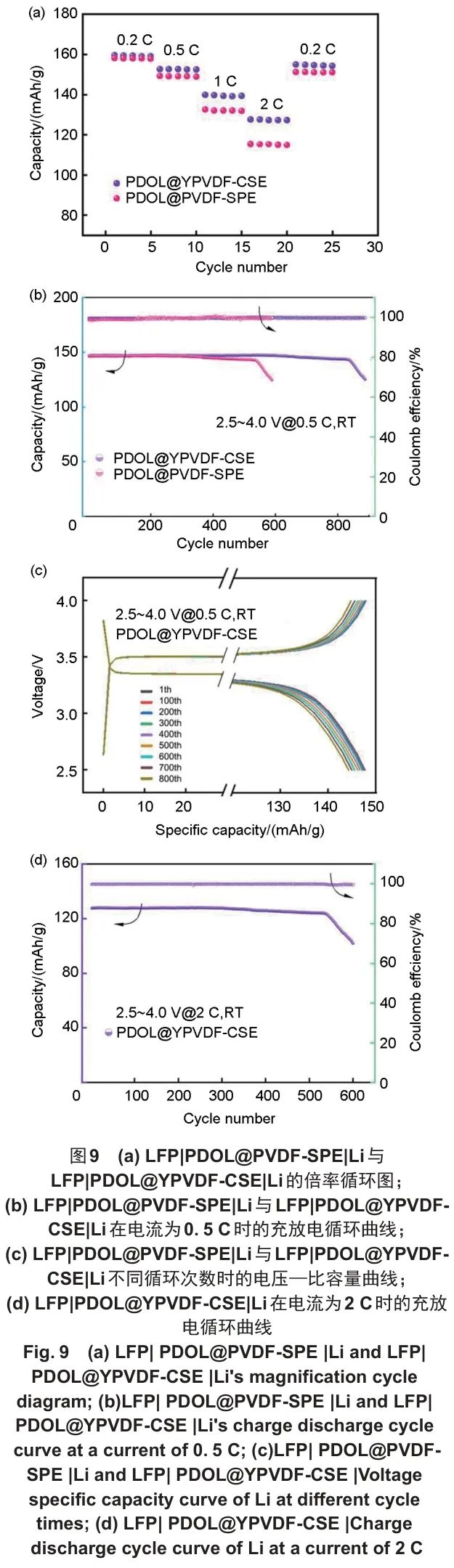
图9 (a) LFP|PDOL@PVDF-SPE|Li与LFP|PDOL@YPVDF-CSE|Li的倍率循环图;(b) LFP|PDOL@PVDF-SPE|Li与LFP|PDOL@YPVDF-CSE|Li在电流为0.5 C时的充放电循环曲线;(c) LFP|PDOL@PVDF-SPE|Li与LFP|PDOL@YPVDF-CSE|Li不同循环次数时的电压—比容量曲线;(d) LFP|PDOL@YPVDF-CSE|Li在电流为2 C时的充放电循环曲线
如图9(b)和(c)所示,在0.5 C倍率时LFP|PDOL@YPVDF-CSE|Li电池的初始放电比容量为147.8 mAh/g,循环800次以后,放电比容量约为143.9 mAh/g,电池容量保持率为97.4%,库仑效率始终稳定维持在99.3%以上。LFP |PDOL@PVDF-SPE|Li电池的初始放电比容量为144.1 mAh/g,在0.5 C倍率时循环600次以后,容量保持率为87.0%。此外,如图9(d)所示,在2 C较大倍率的电流下长循环时,LFP|PDOL@ YPVDF-CSE|Li电池循环500次后的放电比容量为123.7 mAh/g,容量保持率为96.8%,库仑效率维持在99.6%。以上测试结果展现了PDOL@ YPVDF-CSE优异的倍率性能和循环性能。
2.2.5 NCM622||Li电池倍率及其循环性能测试
为了探究PDOL@YPVDF-CSE与高电压正极材料的匹配性,使用NCM622三元锂正极材料组装成NCM622|PDOL@YPVDF-CSE|Li固态电池进行充放电测试。如图10(a)所示,NCM622|PDOL@YPVDF-CSE|Li电池在0.2 C时的放电比容量为189.6 mAh/g,在倍率增加到2 C时,仍有148.9 mAh/g的放电比容量。如图10(b)和(c)所示,1 C倍率循环150次后其放电比容量仍能保持在初始放电比容量的96.2%。展现了其与NCM622正极材料具有良好的适配性,表明了其在高压正极材料和高能量密度固态电池的应用领域中具有一定的潜力和价值。PDOL@YPVDF-CSE在充放电过程中的优良表现,是其优异的电化学性能、良好的界面稳定性等综合作用的结果和体现。
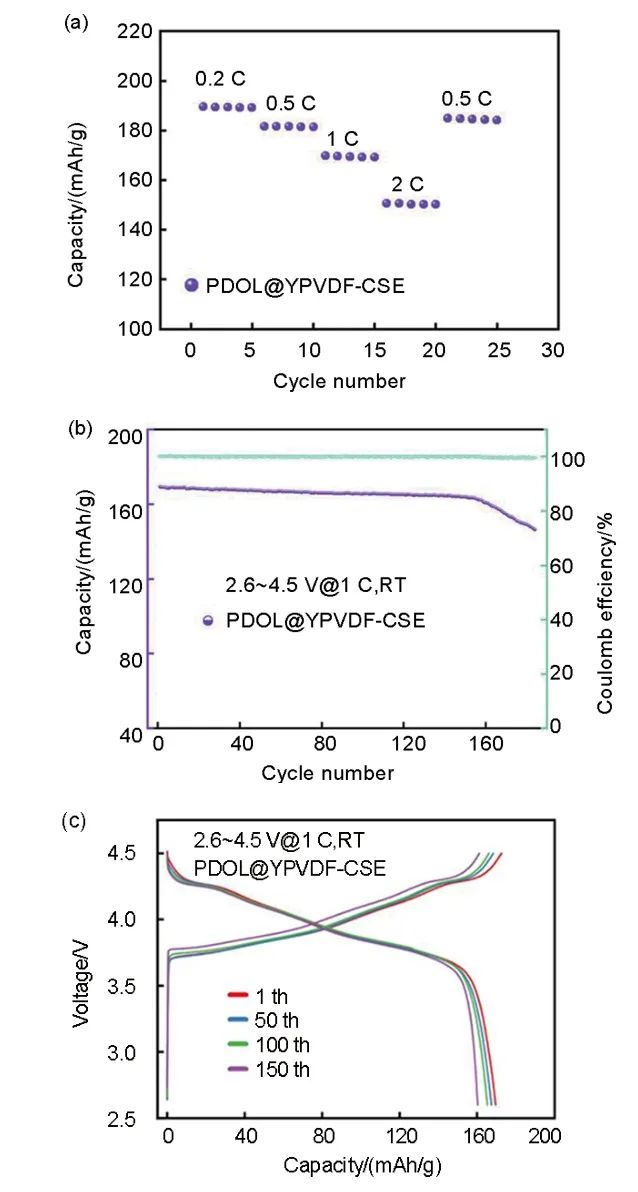
图10 (a) NCM622|PDOL@YPVDF-CSE|Li的倍率循环图;(b) NCM622|PDOL@YPVDF-CSE|Li在不同循环次数时的电压-比容量曲线;(c) NCM622|PDOL@YPVDF-CSE|Li在1 C时的充放电循环曲线
3 结论
本文通过同轴静电纺丝工艺,将YSZ无机纳米颗粒均匀地包覆到PVDF纳米纤维的表面,防止YSZ颗粒在电解质中发生团聚,YSZ的Lewis酸位点能促进DOL单体参与聚合,协同引发剂使DOL单体转化率提升至98.2%。并且YSZ还能有效提升Li+传输效率,使PDOL基复合固态电解质的室温离子电导率达到0.97×10-4 S/cm,以PDOL基复合固态电解质组装的LFP Li和NCM622‖Li两种正极的锂金属电池分别能够稳定循环800次(0.5 C)和150次(1 C)而无明显衰减。本文研究表明,无机纳米颗粒可以通过同轴静电纺丝技术复合到聚合物纳米纤维的表面,用复合纤维膜替代传统隔膜作为原位聚合的基膜,以此制备出的有机—无机复合固态电解质可以获得优异稳定的性能,为复合固态电解质中无机填料的复合方式提供了新的思路。
Li和NCM622‖Li两种正极的锂金属电池分别能够稳定循环800次(0.5 C)和150次(1 C)而无明显衰减。本文研究表明,无机纳米颗粒可以通过同轴静电纺丝技术复合到聚合物纳米纤维的表面,用复合纤维膜替代传统隔膜作为原位聚合的基膜,以此制备出的有机—无机复合固态电解质可以获得优异稳定的性能,为复合固态电解质中无机填料的复合方式提供了新的思路。
